Weitere ausgewählte Publikationen
Auch die innere Uhr muss justiert werden
Neue Einblicke in den molekularen Mechanismus der Drosophila melanogaster, die gemeine Frucht- oder Taufliege
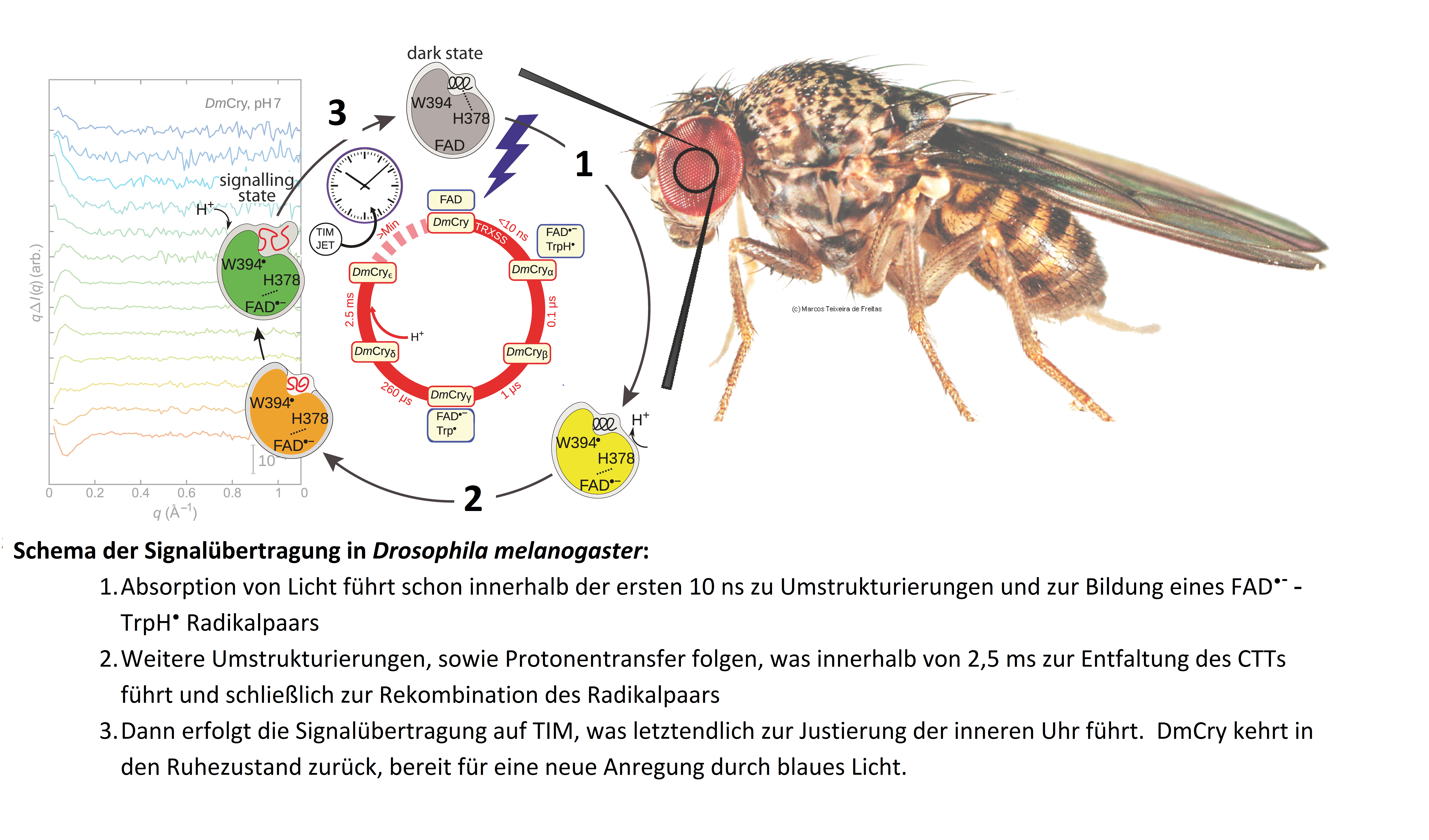 In einer engen internationalen Zusammenarbeit konnten Forscher der Universität Gothenburg und der Universität Freiburg erstmals die molekularen Ereignisse der Signalübermittlung nach Aufnahme von Licht in Echtzeit verfolgen. Dies sind die ersten Schritte, die die Synchronisation der inneren mit der äußeren Uhr möglich machen.
In einer engen internationalen Zusammenarbeit konnten Forscher der Universität Gothenburg und der Universität Freiburg erstmals die molekularen Ereignisse der Signalübermittlung nach Aufnahme von Licht in Echtzeit verfolgen. Dies sind die ersten Schritte, die die Synchronisation der inneren mit der äußeren Uhr möglich machen.
Kolloidale Laves-Kristallphasen: Vorstufe für die Herstellung photonischer Kristalle für die optische Informationstechnologie
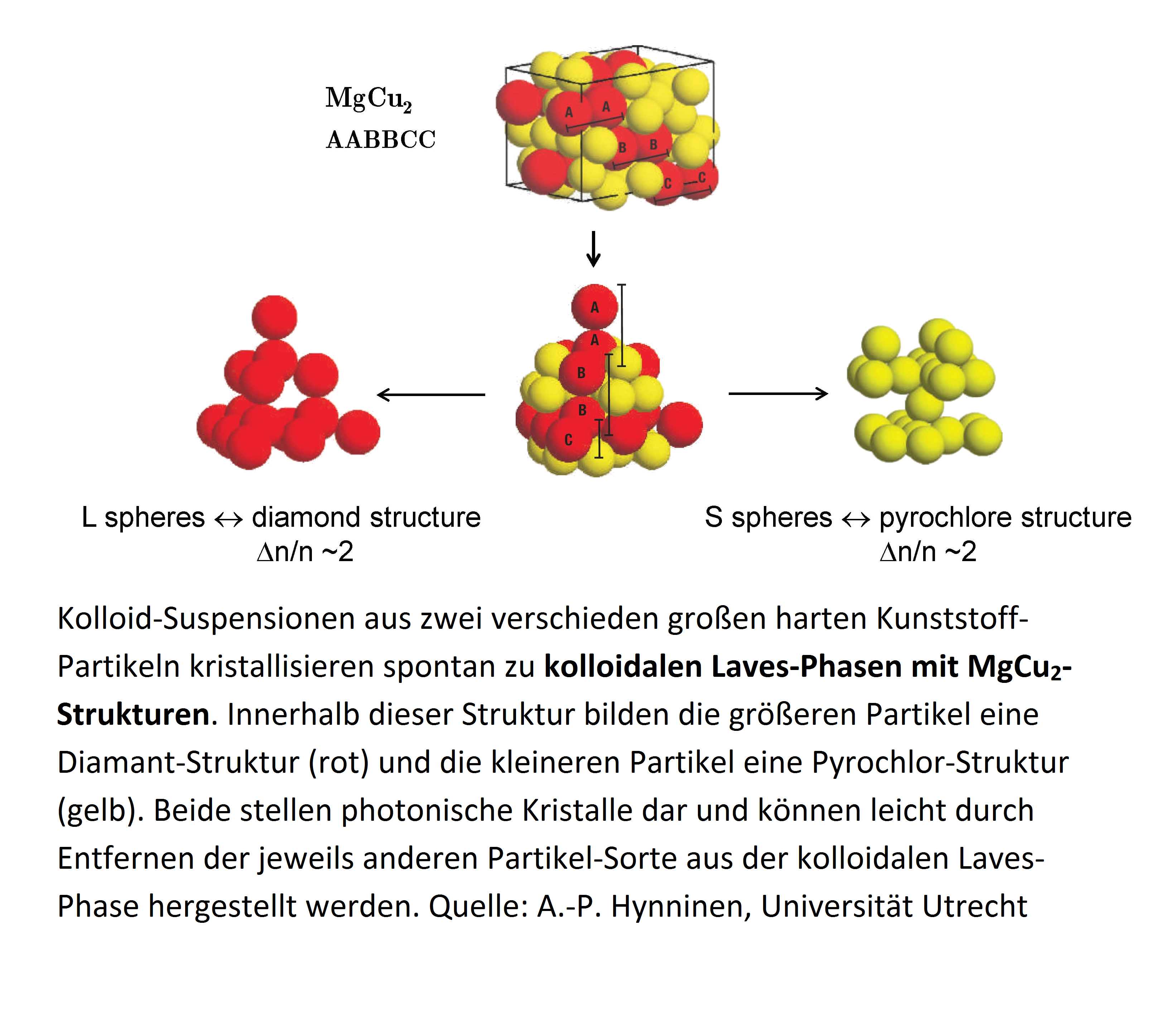 Dr. Nicole Schärtl aus dem Arbeitskreis „Kolloide“ von Prof. Dr. Eckhard Bartsch am Institut für Physikalische Chemie hat erstmals kolloidale Laves-Phasen hergestellt und charakterisiert, wie jetzt in der Fachzeitschrift „Soft Matter“ veröffentlicht. Dies eröffnet endlich die Möglichkeit, die schon seit einigen Jahren mit Hilfe von Computersimu-lationen vorhergesagt wird, über diese Vorstufe photonische Kristalle her-zustellen.
Dr. Nicole Schärtl aus dem Arbeitskreis „Kolloide“ von Prof. Dr. Eckhard Bartsch am Institut für Physikalische Chemie hat erstmals kolloidale Laves-Phasen hergestellt und charakterisiert, wie jetzt in der Fachzeitschrift „Soft Matter“ veröffentlicht. Dies eröffnet endlich die Möglichkeit, die schon seit einigen Jahren mit Hilfe von Computersimu-lationen vorhergesagt wird, über diese Vorstufe photonische Kristalle her-zustellen.
Photonische Kristalle sind nanostrukturierte Materialien mit sehr hohen Brechungsindexkontrasten und können die Fortbewegung von Lichtwellen in molekularen Größenordnungen in festgelegten Richtungen steuern, bestimmte Wellenlängen filtern oder auch reflektieren. Sie haben daher für den Transport von Photonen dieselbe Funktion wie elektrische Halbleiter für den Stromtransport. ... weiterlesen
Dynamik einzelner Proteine
Neue Messmethode erlaubt es Forschenden, die Bewegung von Molekülen lange und genau zu verfolgen
 Das Zusammenspiel aus Struktur und Dynamik bestimmt die Funktion von Proteinen, den molekularen Werkzeugen der Zelle. Durch Fortschritte in der Elektronenmikroskopie können Wissenschaftlerinnen und Wissenschaftler die Strukturinformationen inzwischen gut erfassen, jedoch ist es bisher schwer, die Proteindynamik für eine Analyse über lange Zeiträume hinweg zu messen. Ein Team um Prof. Dr. Thorsten Hugel vom Institut für Physikalische Chemie und dem Exzellenzcluster BIOSS Centre for Biological Signalling Studies der Universität Freiburg und Prof. Dr. Carsten Sönnichsen von der Johannes Gutenberg-Universität Mainz konnte nun mit einer neuen Methode über 24 Stunden hinweg die Dynamik einzelner funktionaler Proteine aufzeichnen. Vergleichbare Messungen waren vorher nur für wenige Sekunden möglich. Vorgehen und Ergebnisse beschreiben sie in einem Artikel in der Fachzeitschrift „Nano Letters“.
Das Zusammenspiel aus Struktur und Dynamik bestimmt die Funktion von Proteinen, den molekularen Werkzeugen der Zelle. Durch Fortschritte in der Elektronenmikroskopie können Wissenschaftlerinnen und Wissenschaftler die Strukturinformationen inzwischen gut erfassen, jedoch ist es bisher schwer, die Proteindynamik für eine Analyse über lange Zeiträume hinweg zu messen. Ein Team um Prof. Dr. Thorsten Hugel vom Institut für Physikalische Chemie und dem Exzellenzcluster BIOSS Centre for Biological Signalling Studies der Universität Freiburg und Prof. Dr. Carsten Sönnichsen von der Johannes Gutenberg-Universität Mainz konnte nun mit einer neuen Methode über 24 Stunden hinweg die Dynamik einzelner funktionaler Proteine aufzeichnen. Vergleichbare Messungen waren vorher nur für wenige Sekunden möglich. Vorgehen und Ergebnisse beschreiben sie in einem Artikel in der Fachzeitschrift „Nano Letters“.
Der Elektronentransfer in der Nitritreduktase – mit zwei Simulationsmethoden zu einem umfassenderen Modell
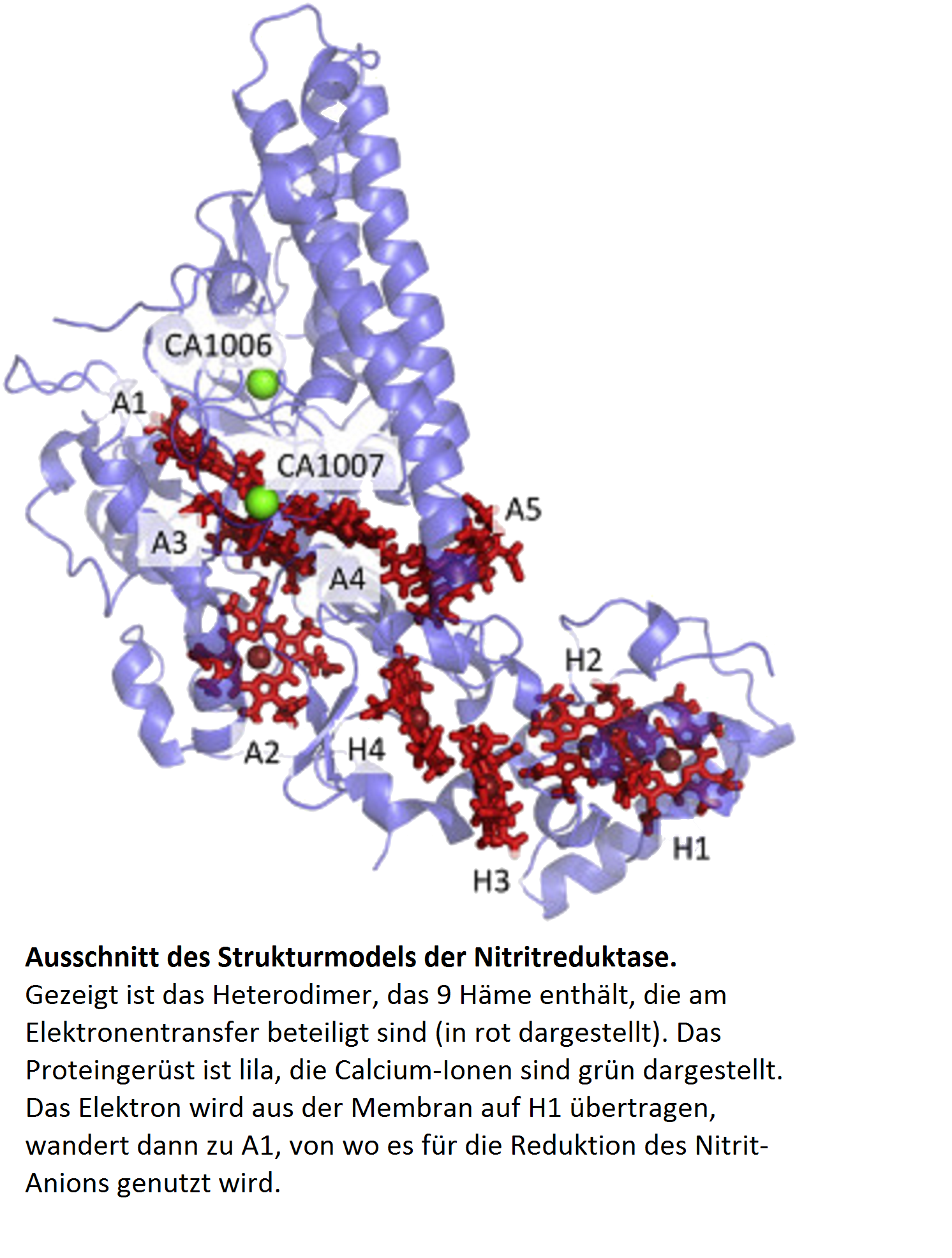 WissenschaftlerInnen des Arbeitskreises Theoretische Chemie von Thorsten Koslowski haben basierend auf der Dielektrizitätstheorie neue Computersimulationen für den Elektronentransfer in der Nitritreduktase aus dem Bakterium D. vulgaris durchgeführt. Die jetzt in der Fachzeitschrift „Biophysical Chemistry“ veröffentlichten Berechnungen ergänzen das 2017 im gleichen Arbeitskreis durch Moleküldynamik ermittelte Modell.
WissenschaftlerInnen des Arbeitskreises Theoretische Chemie von Thorsten Koslowski haben basierend auf der Dielektrizitätstheorie neue Computersimulationen für den Elektronentransfer in der Nitritreduktase aus dem Bakterium D. vulgaris durchgeführt. Die jetzt in der Fachzeitschrift „Biophysical Chemistry“ veröffentlichten Berechnungen ergänzen das 2017 im gleichen Arbeitskreis durch Moleküldynamik ermittelte Modell.
Die Vermessung der Nanowelt
Forscher etablieren einen Maßstab zur genauen Bestimmung von Abständen innerhalb einzelner Moleküle
 Eine weltweite Studie mit Beteiligung von 20 Laboren hat eine Methode etabliert und standardisiert, um exakte Abstände innerhalb einzelner Biomolekülen bis auf ein Millionstel der Breite eines menschlichen Haares zu messen. Die neue Methode stellt eine wesentliche Verbesserung einer Technologie namens „Einzelmolekül-FRET" (Förster Resonanz Energie Transfer) dar, bei der die Bewegung und Wechselwirkung von fluoreszenzmarkierten Molekülen auch in lebenden Zellen in Echtzeit überwacht werden kann.
Eine weltweite Studie mit Beteiligung von 20 Laboren hat eine Methode etabliert und standardisiert, um exakte Abstände innerhalb einzelner Biomolekülen bis auf ein Millionstel der Breite eines menschlichen Haares zu messen. Die neue Methode stellt eine wesentliche Verbesserung einer Technologie namens „Einzelmolekül-FRET" (Förster Resonanz Energie Transfer) dar, bei der die Bewegung und Wechselwirkung von fluoreszenzmarkierten Molekülen auch in lebenden Zellen in Echtzeit überwacht werden kann.
"Hot Article 2018": Auf dem Weg zu leistungsfähigeren organischen Solarzellen – Jetzt hilft die zeitaufgelöste Elektronenspinresonanz-Spektroskopie
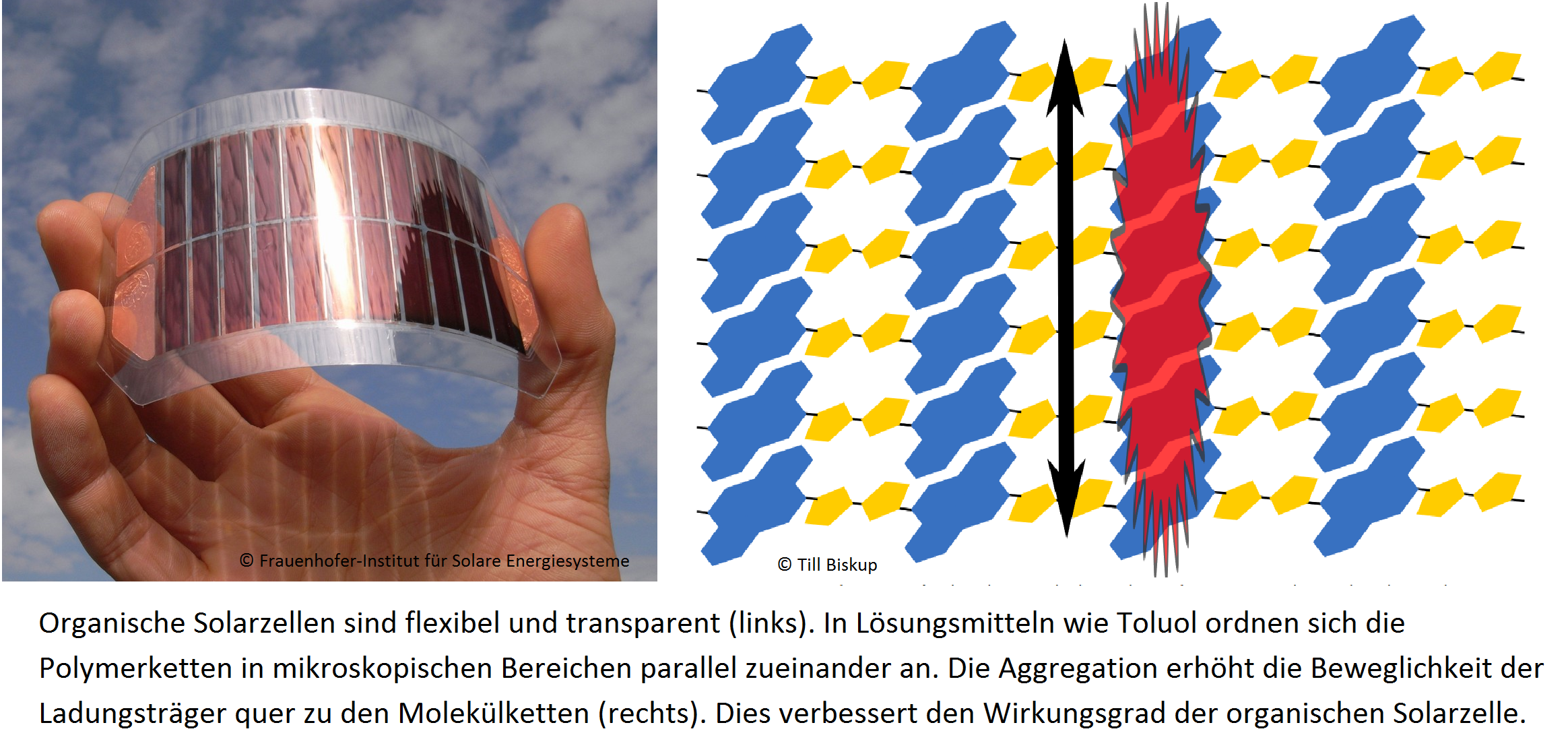 Wissenschaftler der Albert-Ludwigs-Universität Freiburg und der TU Chemnitz haben eine neue Methode entwickelt mit Hilfe der zeitaufgelösten Elektronenspinresonanz-Spektroskopie schon im frühen Stadium der Herstellung organischer Solarzellen die Voraussetzungen für eine effiziente Stromgewinnung bestimmen zu können. Organische Solarzellen haben gegenüber den Silizium-Solarzellen wesentliche Vorteile: Sie sind kostengünstig, leicht zu verarbeiten und haben hohe Stromausbeuten. Sie sind teiltransparent und können in jeder beliebigen Form in kleinen Geräten aber auch großflächig eingesetzt werden. Man stellt sie her, indem man eine Mischung aus halbleitenden organischen Molekülen aus einer konzentrierten Lösung in dünnen Schichten abscheidet. Um die organischen Solarzellen kommerziell nutzen zu können, arbeitet die Wissenschaft intensiv daran, deren Wirkungsgrad auf über 10 Prozent zu steigern. ... weiterlesen
Wissenschaftler der Albert-Ludwigs-Universität Freiburg und der TU Chemnitz haben eine neue Methode entwickelt mit Hilfe der zeitaufgelösten Elektronenspinresonanz-Spektroskopie schon im frühen Stadium der Herstellung organischer Solarzellen die Voraussetzungen für eine effiziente Stromgewinnung bestimmen zu können. Organische Solarzellen haben gegenüber den Silizium-Solarzellen wesentliche Vorteile: Sie sind kostengünstig, leicht zu verarbeiten und haben hohe Stromausbeuten. Sie sind teiltransparent und können in jeder beliebigen Form in kleinen Geräten aber auch großflächig eingesetzt werden. Man stellt sie her, indem man eine Mischung aus halbleitenden organischen Molekülen aus einer konzentrierten Lösung in dünnen Schichten abscheidet. Um die organischen Solarzellen kommerziell nutzen zu können, arbeitet die Wissenschaft intensiv daran, deren Wirkungsgrad auf über 10 Prozent zu steigern. ... weiterlesen
Molecular Modelling von großen Membran-Protein-Komplexen
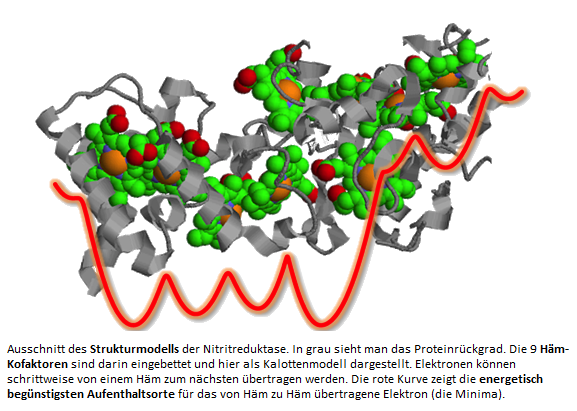 WissenschaftlerInnen der Forschungsgruppe von Thorsten Koslowski haben den Mechanismus des Elektronentransfers in der Nitritreduktase mit Hilfe von Computersimulationen beleuchtet.
WissenschaftlerInnen der Forschungsgruppe von Thorsten Koslowski haben den Mechanismus des Elektronentransfers in der Nitritreduktase mit Hilfe von Computersimulationen beleuchtet.
Dieser Membran-Protein-Komplex überträgt in Pflanzen und Bakterien Elektronen über eine Kette von Häm-Kofaktoren auf ein Nitrit-Anion. So katalysieren diese Enzyme die Reduktion zum Ammonium-Ion, die biologisch wichtigste Stickstoffquelle für das Wachstum der Pflanzen.
Die WissenschaftlerInnen konnten bestimmen, auf welchen in einer Reihe liegenden Häm-Gruppen der Aufenthalt für das Elektron energetisch am günstigsten ist. ...weiterlesen
Wie funktioniert der Magnetsinn in Zugvögeln und Insekten? Charakterisierung von kurzlebigen Radikalpaaren durch gepulste Elektronenspinresonanz-Spektroskopie
 Zugvögel nehmen das erdeigene Magnetfeld richtungsabhängig wahr und orientieren sich so bei ihren weiten Reisen über den Globus. Verantwortlich hierfür sind wahrscheinlich lichtaktive Proteine in der Netzhaut im Auge der Vögel, die Cryptochrome. Diese Wahrnehmung des Erdmagnetfeldes wurde mittlerweile in etwa 50 Tierarten nachgewiesen, unter anderem auch in Fischen, Meeresschildkröten und Insekten.
Zugvögel nehmen das erdeigene Magnetfeld richtungsabhängig wahr und orientieren sich so bei ihren weiten Reisen über den Globus. Verantwortlich hierfür sind wahrscheinlich lichtaktive Proteine in der Netzhaut im Auge der Vögel, die Cryptochrome. Diese Wahrnehmung des Erdmagnetfeldes wurde mittlerweile in etwa 50 Tierarten nachgewiesen, unter anderem auch in Fischen, Meeresschildkröten und Insekten.
Der Mechanismus der Magnetorezeption ist noch weitgehend ungeklärt. In den Cryptochromen kommt es durch Anregung mit blauem Licht spontan zu einem Elektronentransfer im Protein, der zur Bildung eines so genannten Radikalpaares führt. Dieses pendelt ständig zwischen zwei möglichen quantenmechanischen Zuständen hin und her. ... weiterlesen
Entstehungswege von Triplett-Exzitonen – zeitaufgelöste ESR-Spektroskopie an organischen Halbleitern
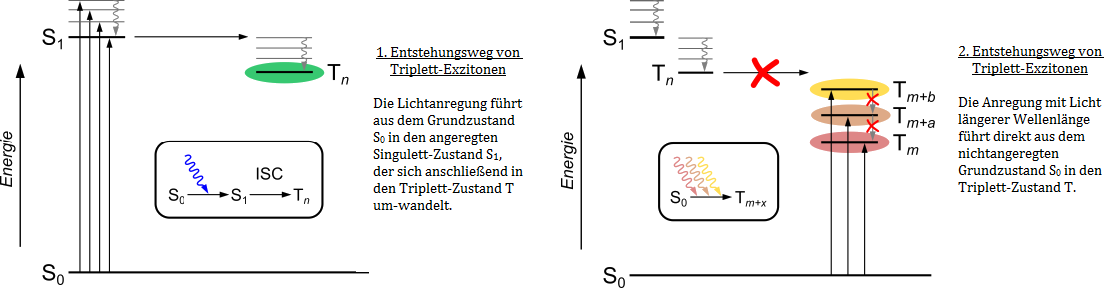
Organische Halbleiter haben in den letzten 20 Jahren stark an Bedeutung gewonnen und finden heute vielfältige Einsatzgebiete in der organischen Elektronik, z.B. in Leuchtdioden (LED), Feldeffekt-Transistoren für die Digitaltechnik und für die Hochfrequenztechnik (Smartphones), Photodetektoren und Solarzellen. Sie haben den großen Vorteil gegenüber den anorganischen Halbleitern (Silizium), dass sie für nahezu jeden gewünschten Zweck passend synthetisiert werden können. Für die Entwicklung effizienter Materialien ist ein detailliertes Verständnis der elektronischen Struktur halbleitender Polymere und ihrer Bausteine zwingende Voraussetzung. Die Höhe der Energieniveaus, sowie die Mikrostruktur und Morphologie des Halbleiters sind dabei wichtige Faktoren. Dazu kommt, dass es in organischen Halbleitern auch zur Bildung von Triplett-Exzitonen kommt, deren Wirkung allerdings stark kontrovers diskutiert wird. ...weiterlesen
Einzelne Proteine bei der Arbeit beobachten Forschungsteam stellt neuen Ansatz vor, um Strukturen und Bewegungen komplexer Moleküle zu veranschaulichen
 Wissenschaftler der Universität Freiburg und der Technischen Universität München haben am Beispiel des Hitzeschockproteins Hsp90 einen Ansatz entwickelt, der neue Einsichten in die Dynamiken komplexer Moleküle ermöglicht.Hsp90 besteht aus mehreren funktional und strukturell voneinander unabhängigen Abschnitten, so genannten Domänen. Diese interagieren unter anderem mit Regulatoren des Zellstoffwechsels wie etwa dem Protein p53. Bislang war es nur möglich, von komplexen Molekülen wie Hsp90 entweder hochaufgelöste statische oder niedrig aufgelöste bewegliche Bilder zu erzeugen. Dem Team ist es nun gelungen, mithilfe von Fluoreszenz hoch aufgelöste bewegte Bilder zu erzeugen, die Hsp90 bei der Arbeit zeigen. ...weiterlesen
Wissenschaftler der Universität Freiburg und der Technischen Universität München haben am Beispiel des Hitzeschockproteins Hsp90 einen Ansatz entwickelt, der neue Einsichten in die Dynamiken komplexer Moleküle ermöglicht.Hsp90 besteht aus mehreren funktional und strukturell voneinander unabhängigen Abschnitten, so genannten Domänen. Diese interagieren unter anderem mit Regulatoren des Zellstoffwechsels wie etwa dem Protein p53. Bislang war es nur möglich, von komplexen Molekülen wie Hsp90 entweder hochaufgelöste statische oder niedrig aufgelöste bewegliche Bilder zu erzeugen. Dem Team ist es nun gelungen, mithilfe von Fluoreszenz hoch aufgelöste bewegte Bilder zu erzeugen, die Hsp90 bei der Arbeit zeigen. ...weiterlesen
Strukturuntersuchung an großen Proteinen mittels PELDOR –
Eine gepulste Elektronenspinresonanz Technik, die Untersuchungen am ganzen Protein in Lösung ermöglicht.
Phytochrome sind Rotlicht-absorbierende Photorezeptoren, die in Abhängigkeit von Licht eine Vielzahl an Prozessen - wie z.B. die Ergrünung von Pflanzenteilen - in Pflanzen, Algen, Pilzen, Bakterien und Cyanobakterien regulieren. Es handelt sich um stark konservierte Proteine, die aus zwei homologen Untereinheiten bestehen. Der N-Terminus bildet jeweils die photosensorischen Domäne (PCM*) mit einem Chromophor, der C-Terminus jeweils die regulatorischen Domäne mit einer Histidinkinase zur Phosphorylierung von Proteine. ...weiterlesen
Kürzer ist nicht immer besser: Neue Pfade für Elektronen
Die molekularen Vorgänge beim Transfer von Ladungen sind für die Konzeption von Werkstoffen zur Energieerzeugung und -verteilung von grundlegender Bedeutung. Dass wir dabei von der Natur noch vieles lernen können, stellten die Gruppen um Stefan Weber und Thorsten Koslowski vom Institut für Physikalische Chemie der Albert-Ludwigs-Universität Freiburg fest.
In Zusammenarbeit mit Kenichi Hitomi und Elizabeth D. Getzoff vom Scripps Research Institute im kalifornischen La Jolla untersuchten Till Biskup und Erik Schleicher aus der Arbeitsgruppe Weber Proteine aus der Familie der Photolyasen und Cryptochrome. ...weiterlesen
Die Funktion des Enzyms Nitrogenase ist ein zentrales Forschungsthema der Arbeitsgruppen von Oliver Einsle und Susana Andrade am Institut für Organische Chemie und Biochemie der Universität Freiburg. Nach der Entdeckung des zentralen Atoms im Metallzentrum war lange nicht klar, welchem chemischen Element dieses Atom zuzuordnen war. In Zusammenarbeit mit Müge Aksoyoglu, Erik Schleicher und Stefan Weber am Institut für Physikalische Chemie in Freiburg und Douglas Rees vom California Institute of Technology in Pasadena (USA), konnte nun durch die Kombination verschiedener analytischer Techniken gezeigt werden, dass es sich bei diesem zentralen Atom in der Tat um Kohlenstoff handelt. ...weiterlesen

