Innere Uhr
Auch die innere Uhr muss justiert werden
Neue Einblicke in den molekularen Mechanismus der Drosophila melanogaster, die gemeine Frucht- oder Taufliege
 In einer engen internationalen Zusammenarbeit konnten Forscher der Universität Gothenburg und der Universität Freiburg erstmals die molekularen Ereignisse der Signalübermittlung nach Aufnahme von Licht in Echtzeit verfolgen. Dies sind die ersten Schritte, die die Synchronisation der inneren mit der äußeren Uhr möglich machen.
In einer engen internationalen Zusammenarbeit konnten Forscher der Universität Gothenburg und der Universität Freiburg erstmals die molekularen Ereignisse der Signalübermittlung nach Aufnahme von Licht in Echtzeit verfolgen. Dies sind die ersten Schritte, die die Synchronisation der inneren mit der äußeren Uhr möglich machen.
Viele Lebewesen haben eine innere Uhr, auch circadiane Uhr (aus dem Lateinischen: „circa“ = „um…herum“ und „dies“ = „Tag“) genannt. Entstanden als Anpassung an die sich über den Tag verändernden Umweltbedingungen, koordiniert sie wichtige Funktionen im Organismus. Bis zu 20 % der Gene eines Organismus sind rhythmisch aktiv. Die circadiane Uhr braucht eigentlich keine äußeren Signale, um ihren Rhythmus beizubehalten. Dennoch kommt es im Laufe der Zeit zu Abweichungen der inneren von der äußeren Uhr. Durch äußere Reize wie das Tageslicht kann die innere Uhr aber wieder genau dem 24-Stunden-Rhyhthmus angepasst werden. Diesen Prozess nennt man Synchronisation oder Entrainment.
In diesem sehr produktiven Forschungsfeld haben Wissenschaftler in den letzten Jahrzehnten wichtige Erkenntnisse erzielt. Sie haben den molekularen Mechanismus des Cryptochroms aus Drosophila melanogaster DmCRY nach Lichtanregung entschlüsselt. Gut untersucht ist auch der endogene Rückkopplungsmechanismus mit den beteiligten Uhrenproteinen PER, TIM und JET. Dieser führt dazu, dass die circadiane Uhr jeden Morgen neu gestartet wird.
Wissenschaftler in den letzten Jahrzehnten wichtige Erkenntnisse erzielt. Sie haben den molekularen Mechanismus des Cryptochroms aus Drosophila melanogaster DmCRY nach Lichtanregung entschlüsselt. Gut untersucht ist auch der endogene Rückkopplungsmechanismus mit den beteiligten Uhrenproteinen PER, TIM und JET. Dieser führt dazu, dass die circadiane Uhr jeden Morgen neu gestartet wird.
Unerforscht ist aber der genaue molekulare Mechanismus, wie die Signalübermittlung nach der Lichtanregung zu den Uhrenproteinen erfolgt und eine Synchronisation der inneren Uhr mit der äußeren ermöglicht.
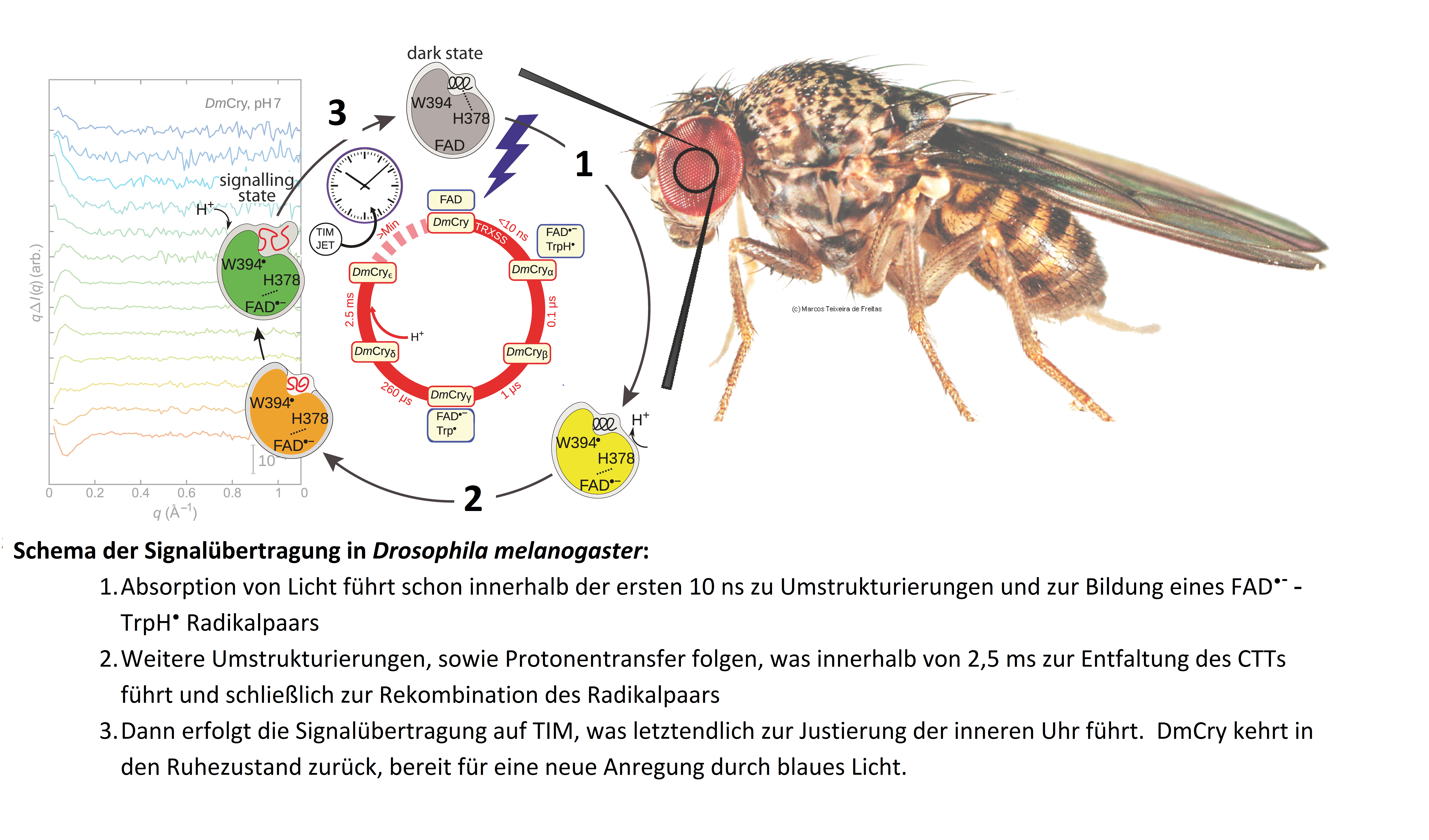
Die Forscherinnen und Forscher konnten jetzt zeigen, dass nach Absorption von blauem Licht und dem Transfer eines Elektrons eine Reihe von Umstrukturierung im DmCRY erfolgt, wobei schließlich in einem pH-abhängigen Schritt das ca. 20 Aminosäuren lange C-terminale Ende des DmCRYs abgespalten wird. Das so aktivierte DmCRY kann jetzt an das Uhrenprotein TIM binden und dessen Abbau aktivieren, was letztlich zu einer Justierung der circadianen Uhr führt.
In der Abbildung ist dieser molekulare Mechanismus inklusive der genauen zeitlichen Abläufe schematisch dargestellt.
Um die Strukturänderungen (sowie den Elektronentransfer) in Echtzeit in einem Zeitfenster von Nano- bis Millisekunden verfolgen zu können, hat das Forscherteam eine Kombination aus zeitaufgelöster Röntgenstreuung (TRXSS =Time-resolved X-ray small-angle scattering) und transienter Absorptionsspektroskopie, sowie Molecular Dynamics (MD) Simulationen verwendet.
Mit diesen Methoden wird es nun den Forschern aus Gothenburg und Freiburg möglich sein, die weiteren Schritte des molekularen Mechanismus, der zur Justierung der inneren Uhr führt, zu entschlüsseln.
Originalpublikation:
O. Berntsson, R. Rodriguez, L. Henry, M.R. Panman, A.J. Hughes, C. Einholz, S. Weber, J.A. Ihalainen, R. Henning, I. Kosheleva, E. Schleicher, S. Westenhoff
Photoactivation of Drosophila melanogaster cryptochrome through sequential conformational transitions
Science Advances 5 (2019) Art.-No. eaaw1531
DOI: 10.1126/sciadv.aaw153
https://advances.sciencemag.org/content/5/7/eaaw1531
Kontakt:
Prof. Dr. Erik Schleicher
Institut für Physikalische Chemie
Albert-Ludwigs-Universität Freiburg
Telefon: +49 761 / 203-6204
Telefax: +49 761 / 203-6222
Email: erik.schleicher@physchem.uni-freiburg.de
Weitere Pressemeldungen zu dieser Publikation:
https://www.aps.anl.gov/APS-Science-Highlight/All (ab Mitte Dezember)

