"Hot Papers"
Können amphiphile Moleküle wie Kokain
die Lipiddoppelschicht von Zellmembranen passieren?
Klassische Molekulardynamik-Simulationen geben dazu Einblicke.
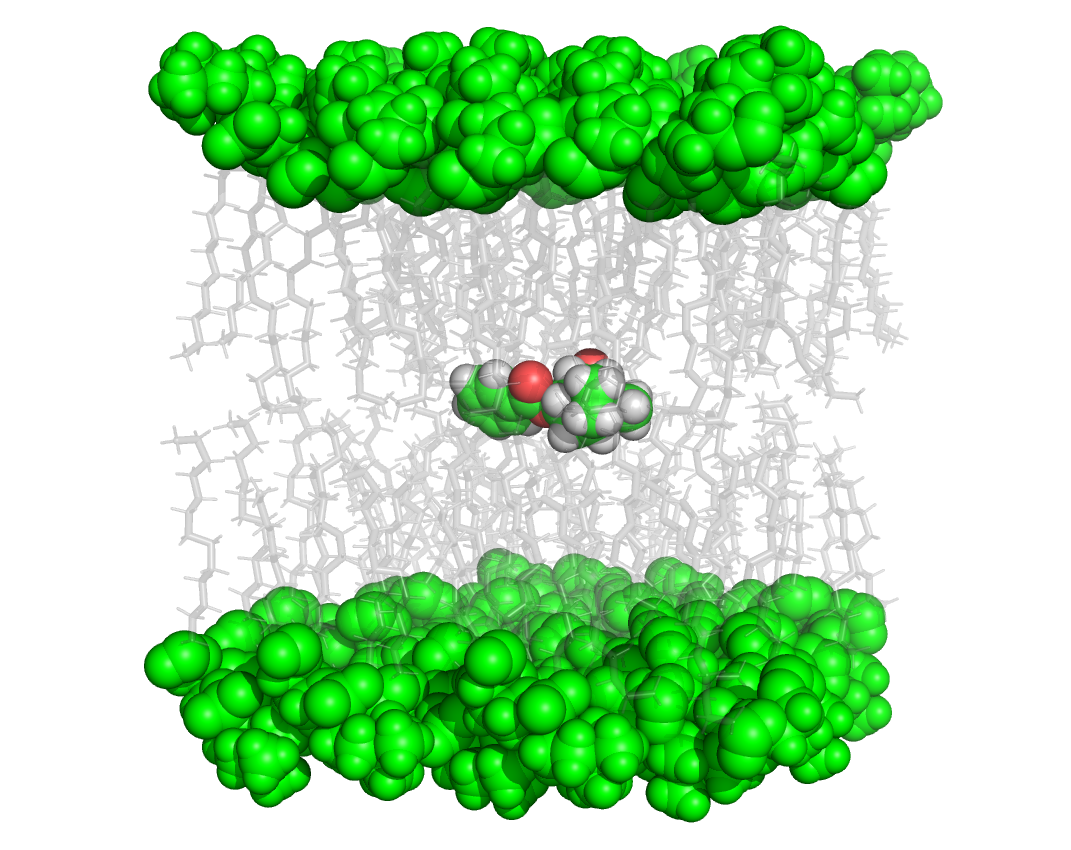
Die Computersimulation der Bewegung von Molekülen in großen Systemen ermöglicht es heute, wichtige biologische Systeme, wie die Lipiddoppelschicht von Membranen, zu untersuchen. Lipiddoppelschichten sind als semipermeable Membran zentral für die Funktion von Zellen. Sie bilden eine Barriere nach außen und ermöglichen eine Kompartimentierung der verschiedenen Zellfunktionen im Inneren. Für die Forschung von Interesse ist, wie kleine Moleküle, also medizinische Wirkstoffe, kleine Peptide und ähnliches, die Lipiddoppelschicht passieren können.
Wissenschaftler und Wissenschaftlerinnen aus Freiburg und Tunis haben in Zusammenarbeit zu dieser Frage das Molekül Kokain in den Fokus genommen und mit Hilfe der klassischen Molekulardynamik-Simulation die Diffusion von Kokain durch eine Lipiddoppelschicht untersucht. ... weiterlesen
Neue Einblicke in die Bewegung einzelner Moleküle
Wie mit Methoden aus der Physik biologische Prozesse entschlüsselt werden können
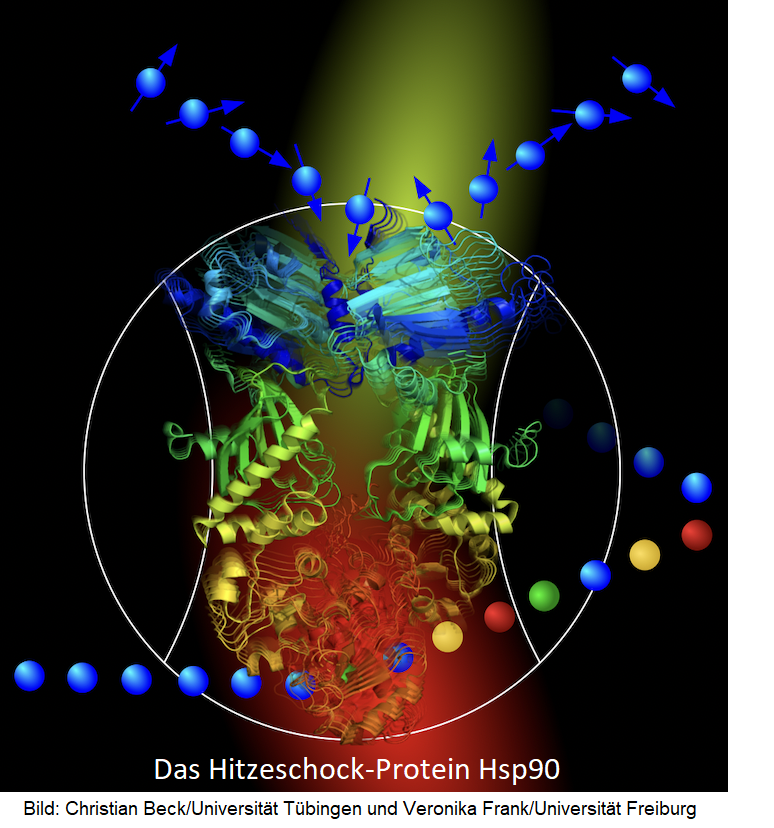
Die Proteine in unseren Zellen sind aufgrund der thermischen Bewegung von Atomen und Molekülen ständig in Bewegung. Neben diesem schnellen und ungeordneten „Zittern“ finden in der Zelle auch langsamere Bewegungen wie das Auf- und Zuklappen von Proteinen statt. Solche Bewegungen sind wichtige Kontrollmechanismen für die Funktion von Proteinen. Ein internationales und interdisziplinäres Team unter Leitung von Forschenden der Universität Freiburg, Tübingen und Lund hat jetzt zum ersten Mal untersucht, wie diese verschiedenen Moleküldynamiken zusammenhängen.
„Wir wollten herausfinden, wie aus den schnellen, ständig stattfindenden Molekülbewegungen heraus die Wechsel zwischen funktionalen Zuständen resultieren,“ erklärt Prof. Dr. Thorsten Hugel, der am Institut für Physikalische Chemie der Universität Freiburg forscht und Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies - ist. „Dafür haben wir nicht nur einzelne Moleküle untersucht, was an sich schon technisch extrem anspruchsvoll ist, sondern deren Bewegungen im Bereich von Millionstel Sekunden“, sagt Hugel. ... weiterlesen
NMR Spectroscopy - Hot Paper
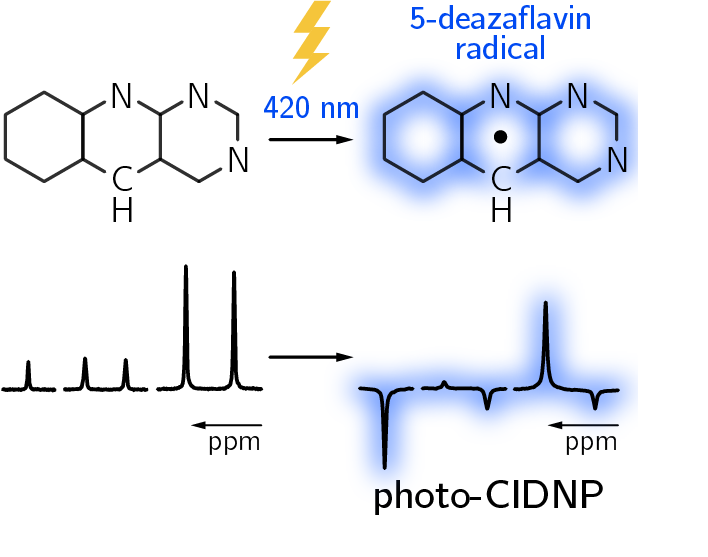
5-Deazaflavine reagieren auch als Ein-Elektronenüberträger
Charakterisierung der elektronischen Struktur von 5-Deazaflavin-Radikalen durch photo-CIDNP-NMR
5-Deazaflavine sind Analoga der Flavinen. Dabei ist das N-5 Stickstoffatom im Isoalloxazin Ring durch ein Kohlenstoffatom ersetzt.
Flavine sind weitverbreitete kovalent gebundene Cofaktoren in Enzymen, die reversibel ein oder zwei Elektronen aufnehmen oder abgeben können, und an einer Vielzahl an Redoxreaktionen in Organismen beteiligt sind. Zudem absorbieren sie auch im sichtbaren Wellenbereich. Die Photoreduktions-reaktionen unter Blaulicht werden z.B. von den Phototropinen für das lichtgerichtete Pflanzenwachstum, von Photolyasen, um die UV-Schaden an der DNA zu reparieren, und von Cryptochromen bei der Regulierung des Circadianen Rhythmus genutzt.
Die 5-Deazaflavine haben sich aufgrund der strukturellen Ähnlichkeit sehr wertvoll als Substituenten bei der Untersuchung der Reaktionsmechanismen in Flavoproteinen gezeigt. ...weiterlesen
Ist Cryptochrom 4 der gesuchte Kompass in der Netzhaut von Zugvögeln?
Transiente EPR Spektroskopie im Institut für Physikalische Chemie
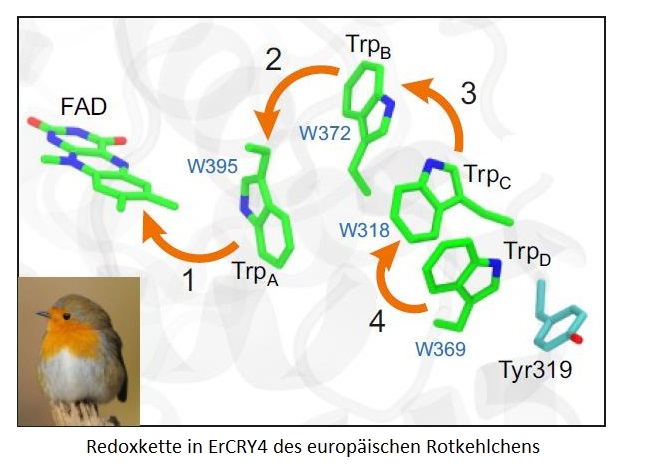 Viele Tierarten nutzen das Magnetfeld der Erde um sich zu orientieren. Besonders Zugvögel legen sehr große Strecken zuverlässig über festgelegte Routen zurück. Für Vögel, die nachts ziehen, wie das Rotkehlchen, spielt der Magnetsinn dabei eine zentrale Rolle. Aber auch Vögel, die nicht oder kaum ziehen, wie die Taube oder das Huhn, nehmen das Erdmagnetfeld wahr.
Viele Tierarten nutzen das Magnetfeld der Erde um sich zu orientieren. Besonders Zugvögel legen sehr große Strecken zuverlässig über festgelegte Routen zurück. Für Vögel, die nachts ziehen, wie das Rotkehlchen, spielt der Magnetsinn dabei eine zentrale Rolle. Aber auch Vögel, die nicht oder kaum ziehen, wie die Taube oder das Huhn, nehmen das Erdmagnetfeld wahr.
Wie dieser Magnetsinn funktioniert und wo er im Körper verankert ist, untersuchen Wissenschaft-lerinnen und Wissenschaftler seit Jahren. Dabei wird angenommen, dass der Magnetsinn auf ein lichtabhängiges Radikalpaar-System in der Netzhaut der Augen der Vögel beruht, das wie ein Kompass sensitiv auf das lokale Magnetfeld reagiert.
In zwei großen internationalen Studien konnten jetzt Forschende zeigen, dass Cryptochrom 4 (CRY4) in der Netzhaut von Vögeln ein sehr geeigneter Kandidat ist, die Funktion eines lichtinduzierten magnetischen Kompasses innezuhaben. ...weiterlesen
Hierarchische Dynamik
Forschende untersuchen die auf vielen Zeitskalen stattfindenden Signalübertragung in Proteinen
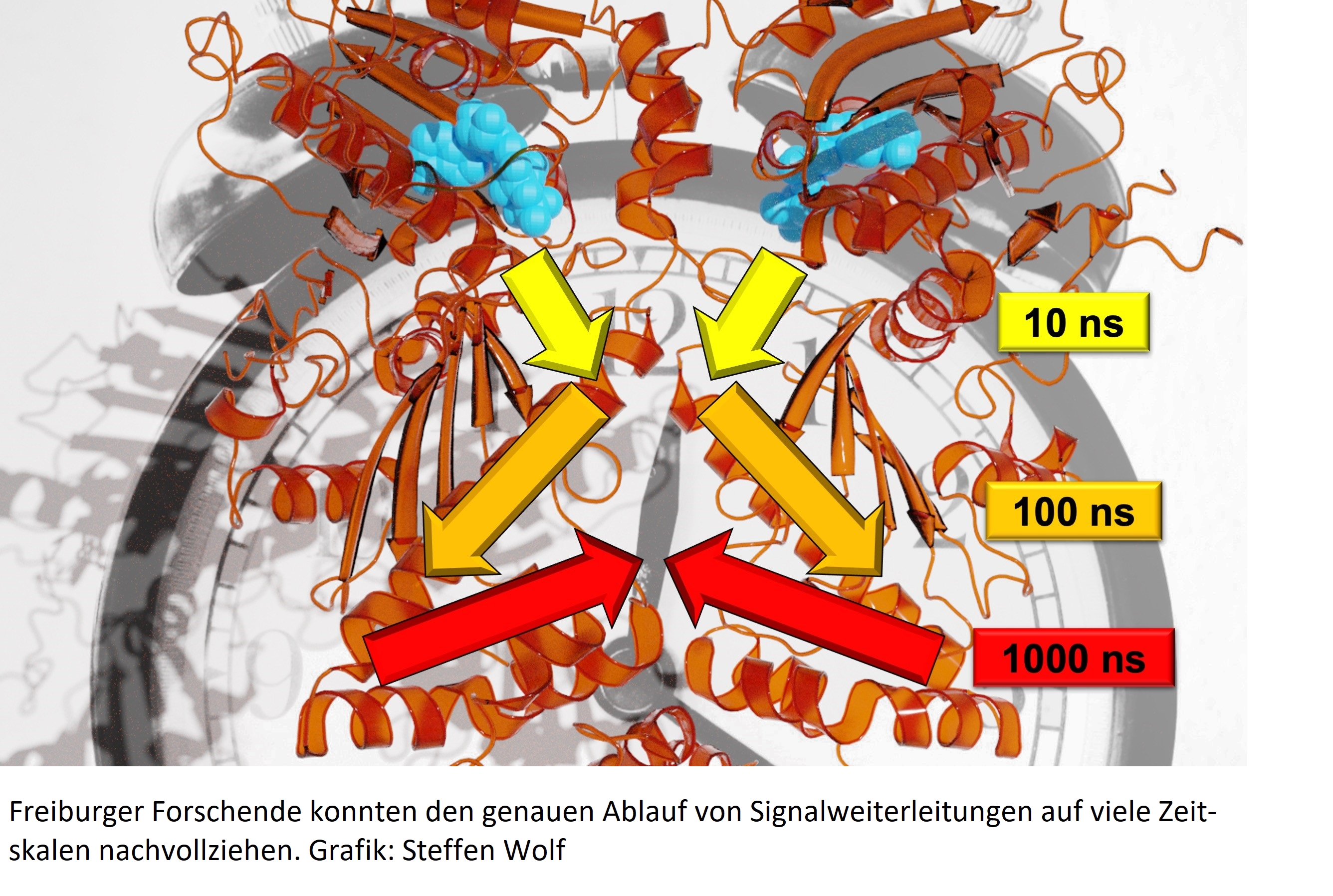
Ein Baum, der sich im Wind bewegt: Wie lange dauert es, bis die Bewegung eines Zweiges am Baumstamm ankommt? Und über welchen Weg überträgt sich diese Bewegung? Diese Fragen übertragen Forschende der Albert-Ludwigs-Universität auf Proteine, die molekularen Maschinerien der Zelle. Ein Team um Prof. Dr. Thorsten Hugel von Institut für Physikalische Chemie sowie Dr. Steffen Wolf und Prof. Dr. Gerhard Stock von Institut für Physik untersucht, wie die Signale, die in Proteinen strukturelle Veränderungen hervorrufen, von einem Ort zum anderen gelangen und wie schnell das geschieht. Da bei solchen Signalweiterleitungen viele Zeitskalen, von Nanosekunden bis Sekunden, involviert sind, konnten Wissenschaftlerinnen und Wissenschaftler den genauen Ablauf bisher nicht analysieren. Indem sie verschiedene Experimente, Simulationen und theoretische Studien kombiniert haben, ist es den Freiburger Forschern nun aber gelungen. Ihre Ergebnisse veröffentlichten sie in der Fachzeitschrift Chemical Science. ...weiterlesen