Institut für Physikalische Chemie
Albert-Ludwigs-Universität Freiburg
Albertstrasse 23a
D-79104 Freiburg im Breisgau
Akademischer Werdegang
Forschung
H+-ATPase.
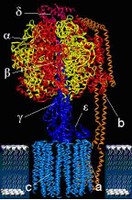 H+-ATPsynthasen sind membrangebundene Proteine, die die ATP-Synthese aus ADP und Phosphat katalysieren. Energetisch wird dies durch Kopplung der energieverbrauchenden chemischen Reaktion mit einem energieliefernden transmembranen Protonentransport ermöglicht. H+-ATPsynthasen bestehen aus einem hydrophoben, membranintegrierten F0-Teil und einem hydrophilen F1-Teil, der in den cytoplasmatischen Raum ragt. In E. coli hat der F0-Teil die Untereinheiten ab2c9-14 und ist für den Protonentransport durch die Membran verantwortlich. Dabei bilden die c-Untereinheiten ein in die Membran eingebettetes Oligomer, an dem sich außen die beiden b- und die a-Untereinheiten befinden. Die b-Untereinheiten bilden eine außen liegenden Verbindung (über a und d) zwischen F0 und F1. Der F1-Teil hat die stöchiometrische Zusammensetzung α3β3γδε, wobei der α3β3-Komplex drei katalytische Nukleotidbindungsplätze und drei nicht-katalytische Bindungsplätze bildet. Die γ- und ε- Untereinheiten bilden die zentrale Verbindung zwischen dem F0- und dem F1-Teil und sind Teil des Rotors.
H+-ATPsynthasen sind membrangebundene Proteine, die die ATP-Synthese aus ADP und Phosphat katalysieren. Energetisch wird dies durch Kopplung der energieverbrauchenden chemischen Reaktion mit einem energieliefernden transmembranen Protonentransport ermöglicht. H+-ATPsynthasen bestehen aus einem hydrophoben, membranintegrierten F0-Teil und einem hydrophilen F1-Teil, der in den cytoplasmatischen Raum ragt. In E. coli hat der F0-Teil die Untereinheiten ab2c9-14 und ist für den Protonentransport durch die Membran verantwortlich. Dabei bilden die c-Untereinheiten ein in die Membran eingebettetes Oligomer, an dem sich außen die beiden b- und die a-Untereinheiten befinden. Die b-Untereinheiten bilden eine außen liegenden Verbindung (über a und d) zwischen F0 und F1. Der F1-Teil hat die stöchiometrische Zusammensetzung α3β3γδε, wobei der α3β3-Komplex drei katalytische Nukleotidbindungsplätze und drei nicht-katalytische Bindungsplätze bildet. Die γ- und ε- Untereinheiten bilden die zentrale Verbindung zwischen dem F0- und dem F1-Teil und sind Teil des Rotors.
 Das von Boyer vorgeschlagene binding-change-Modell für den Katalysemechanismus geht von drei identischen Bindungsplätzen aus, die strenge Kooperativität zeigen. Jeder Bindungsplatz durchläuft dabei eine Abfolge von drei Konformationen. Die Rotationsbewegung der γ-Untereinheit induziert die Konformationsänderungen in den katalytischen Bindungstaschen.
Das von Boyer vorgeschlagene binding-change-Modell für den Katalysemechanismus geht von drei identischen Bindungsplätzen aus, die strenge Kooperativität zeigen. Jeder Bindungsplatz durchläuft dabei eine Abfolge von drei Konformationen. Die Rotationsbewegung der γ-Untereinheit induziert die Konformationsänderungen in den katalytischen Bindungstaschen.
Weder die Struktur der vollständigen H+-ATPsynthase noch der genaue Mechanismus der Energieübertragung zwischen der F0- und der F1-Einheit ist abschließend geklärt. Bisherige Experimente deuten darauf hin, dass die γ-Untereinheit die Energie der Protonierung-Deprotonierung der c-Untereinheiten durch eine Drehbewegung (c9-12, ε und γ-Untereinheiten bilden den Rotor, blau im linken Bild) auf den α3β3-Komplex (zusammen mit a, b2 und δ bilden sie den Stator, braun im linken Bild) übertragen könnte.
Bakterielle Reaktionszentren
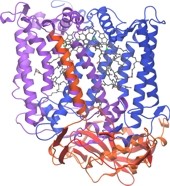 Die Photosynthese findet in den Chloroplasten von Algen und höheren Pflanzen sowie in Cyanobakterien und photosynthetischen Bakterien statt. Um die elektromagnetische Energie des Sonnenlichts in chemisch gebundene Energie umzuwandeln, werden einzelne Lichtquanten durch Lichtsammelkomplexe in der Zellmembran absorbiert und zu den Reaktionszentren weitergeleitet. Dort findet eine photoinduzierte transmembrane Ladungstrennung statt. Die so gespeicherte Energie läßt sich anschließend in einer Reihe von lichtunabhängigen Reaktionen (Dunkelreaktion der Photosynthese) in das für alle Lebewesen als Energieüberträger dienende Adenosintriphosphat (ATP) und in Reduktionsäquivalente umwandeln. In weiteren Reaktionen werden diese Substanzen zur Fixierung von CO2 sowie für die Synthese chemischer Verbindungen, die die Zelle benötigt (wie z.B. Kohlenhydrate), eingesetzt.
Die Photosynthese findet in den Chloroplasten von Algen und höheren Pflanzen sowie in Cyanobakterien und photosynthetischen Bakterien statt. Um die elektromagnetische Energie des Sonnenlichts in chemisch gebundene Energie umzuwandeln, werden einzelne Lichtquanten durch Lichtsammelkomplexe in der Zellmembran absorbiert und zu den Reaktionszentren weitergeleitet. Dort findet eine photoinduzierte transmembrane Ladungstrennung statt. Die so gespeicherte Energie läßt sich anschließend in einer Reihe von lichtunabhängigen Reaktionen (Dunkelreaktion der Photosynthese) in das für alle Lebewesen als Energieüberträger dienende Adenosintriphosphat (ATP) und in Reduktionsäquivalente umwandeln. In weiteren Reaktionen werden diese Substanzen zur Fixierung von CO2 sowie für die Synthese chemischer Verbindungen, die die Zelle benötigt (wie z.B. Kohlenhydrate), eingesetzt.
Methoden
Publikationen
Hier finden Sie die vollständige Publikationsliste
Fünf ausgewählte Publikationen:
- Th. Friedrich, O. Einsle, P. Gräber (2012) Biochim. Biophys. Acta 1817 (2012) 1709-1710
EBEC 2012: Combining the multiple facets of bioenergetics
- J.Petersen, K. Förster, P. Turina and P. Gräber (2012) PNAS 281 (2012) 11150-11155
Comparison of the H+/ATP ratios of the H+-ATPsynthases from yeast and from chloroplast
- R. Bienert, V. Rombach-Riegraf, M. Diez and P. Gräber (2009) Journal of Biological Chemistry 284 (52) (2009) 36240-36247
Subunit movements in single membrane-bound H+-ATPsynthases from Chloroplasts during ATP Synthesis
- B. Zimmermann, M. Diez, N. Zarrabi , P. Gräber, M. Börsch (2005), The EMBO Journal 24 (2005) 2053-2063
Movements of e-subunit during catalysis and activation in single membrane-bound H+-ATPsynthase
- M. Diez, B. Zimmermann, M. Börsch, M. König, E. Schweinberger, S. Steigmiller, R. Reuter, S. Felekyan, V. Kudryavtsev, C. Seidel and P. Gräber (2004) Nature Structural & Molecular Biology 11 (2004) 135-141
Proton-powered subunit rotation in single membrane-bound F0F1-ATPsynthase